Le cofacteur cellulaire CTIP2 contribue à l’établissement des réservoirs latents en recrutant HDAC1/HDAC2 et SUV39H1 sur le promoteur viral. HDAC1/HDAC2 et SUV39h1 vont respectivement déacétyler et tri-méthyler la lysine 9 de l'histone H3, établissant ainsi un environnement hétérochromatinien transcriptionnellement inactif.
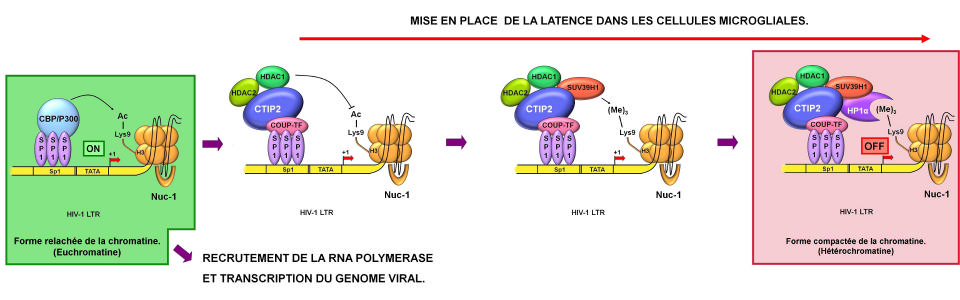 Recruitment of chromatin-modifying enzymes by CTIP2 promotes HIV-1 transcriptional silencing. EMBO J. 2007. Accès à la publication
Recruitment of chromatin-modifying enzymes by CTIP2 promotes HIV-1 transcriptional silencing. EMBO J. 2007. Accès à la publication
La Lysine déméthylase LSD1 coopère avec CTIP2 pour établir la latence virale. LSD1 sert de plateforme d’ancrage à CTIP2, qui permet la fixation du complexe de modification de la chromatine précedement décrit, mais aussi permet le recrutement du complexe hCOMPASS, à l'origine de la tri-méthylation de la lysine 4 de l'histone H3.
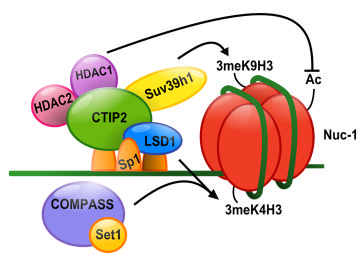 LSD1 cooperates with CTIP2 to promote HIV-1 transcriptional silencing. Nucleic Acids Res. 2012. Accès à la publication
LSD1 cooperates with CTIP2 to promote HIV-1 transcriptional silencing. Nucleic Acids Res. 2012. Accès à la publication
Le ciblage thérapeutique de la Histone méthyl transférase SUV39H1 permet de réactiver le virus latent et donc de réduire la quantité de réservoir.
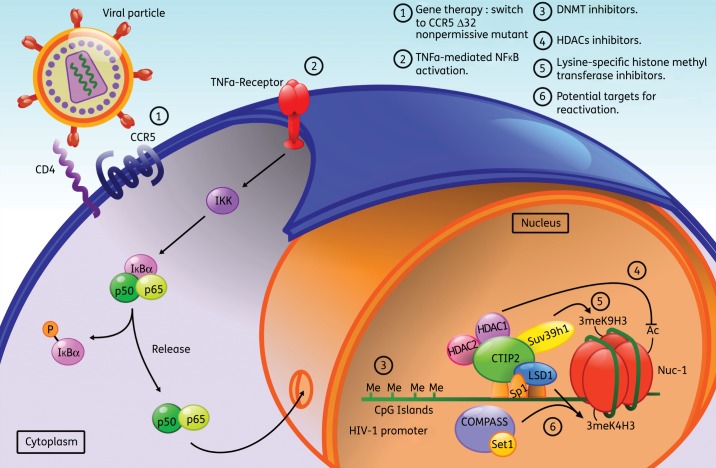 Histone Methyltransferase inhibitors induce HIV-1 recovery in resting CD4(+) T cells from HIV-1-infected HAART-treated patients. AIDS 2012. Accès à la publication
Histone Methyltransferase inhibitors induce HIV-1 recovery in resting CD4(+) T cells from HIV-1-infected HAART-treated patients. AIDS 2012. Accès à la publication
CTIP2 contribue également à la persistance des réservoirs en réprimant le facteur d’élongation P-TEFb. CTIP2 est simultanément associé au complexe inactif de P-TEFb et au snRNA 7sk dans lequel il réprime l'activité kinase de la sous-unité catalytique CdK9. Par ailleurs des approches transcriptomiques ont permis de mettre en evidence l'impact de CTIP2 sur la régulation de voies de signalisations intracellulaire impliquées dans la cancérogénèse ainsi que dans l'hypertrophie cardiaque.
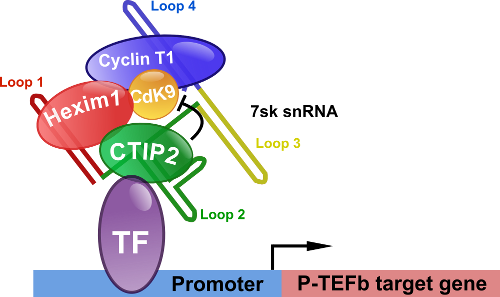 CTIP2 is a negative regulator of P-TEFb. Proc Natl Acad Sci USA. 2013. Accès à la publication
CTIP2 is a negative regulator of P-TEFb. Proc Natl Acad Sci USA. 2013. Accès à la publication